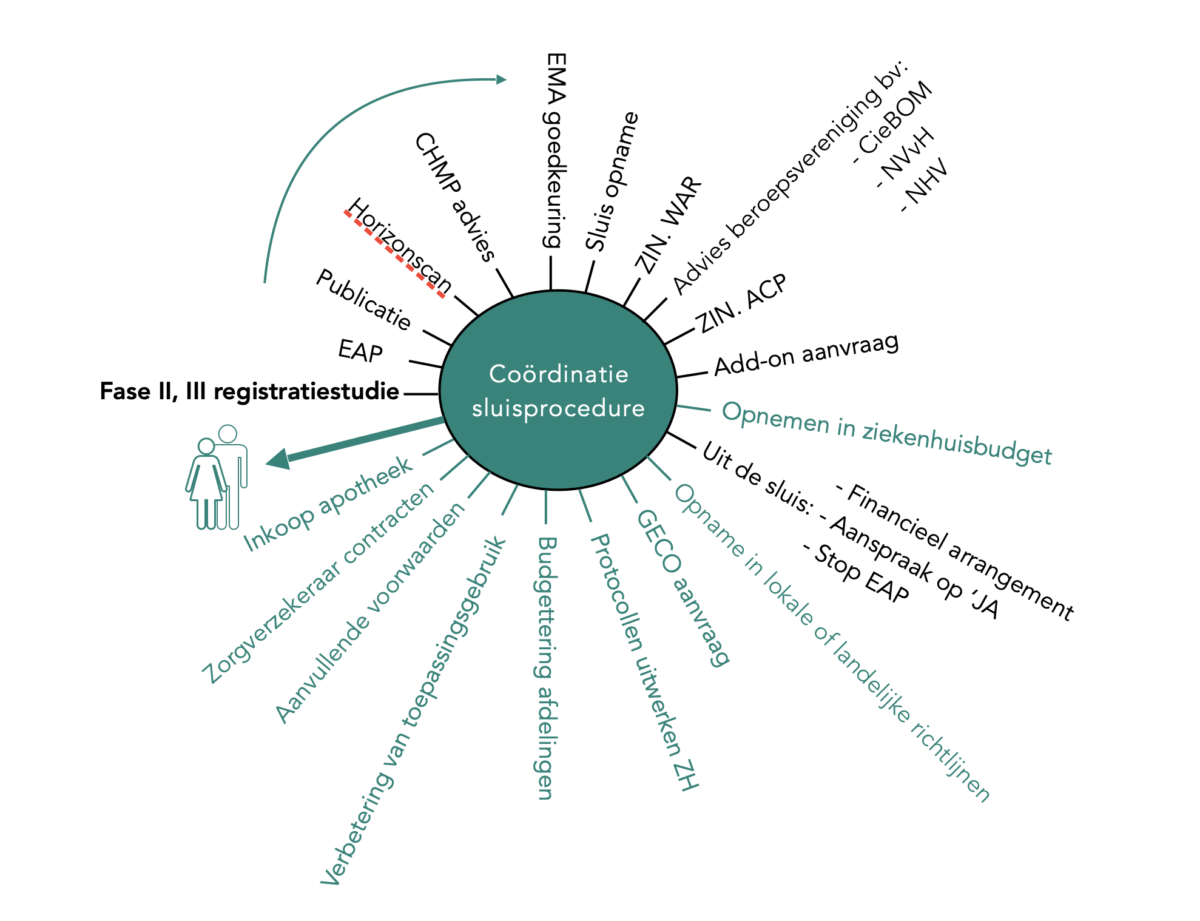
Wheel of access en sluis
Criteria voor plaatsing van een geneesmiddel in de sluis zijn volledig financieel gedreven, namelijk totaal verwachtte kosten van tenminste €20 miljoen per jaar in Nederland of tenminste €10 miljoen per indicatie en tenminste €50.000 per patiënt.
Het Wheel of access is een organiserend principe wat handvatten biedt voor markt- en ziekenhuistoegang van add-ongeneesmiddelen. De fase II en III registratiestudies zijn het vertrekpunt voor markttoelating en eindigt bij het voorschrijven aan patiënten.
- De bovenste helft van het ‘Wheel of access’ zijn formele processtappen die door de overheid worden bepaald. Dit zijn markttoelatingsvoorwaarden. De gemiddeld tijd hiervoor bedraagt 20 maanden (600 dagen) met een maximum van 50 maanden.
- De onderste helft van het ‘Wheel of access’ beschrijft de afstemmingsprocessen die ziekenhuizen moeten doorlopen om het geneesmiddel uiteindelijk aan patiënten te kunnen voorschrijven. Ook hier kan de doorlooptijd sterk variëren en ligt tussen de 1 en 6 maanden.