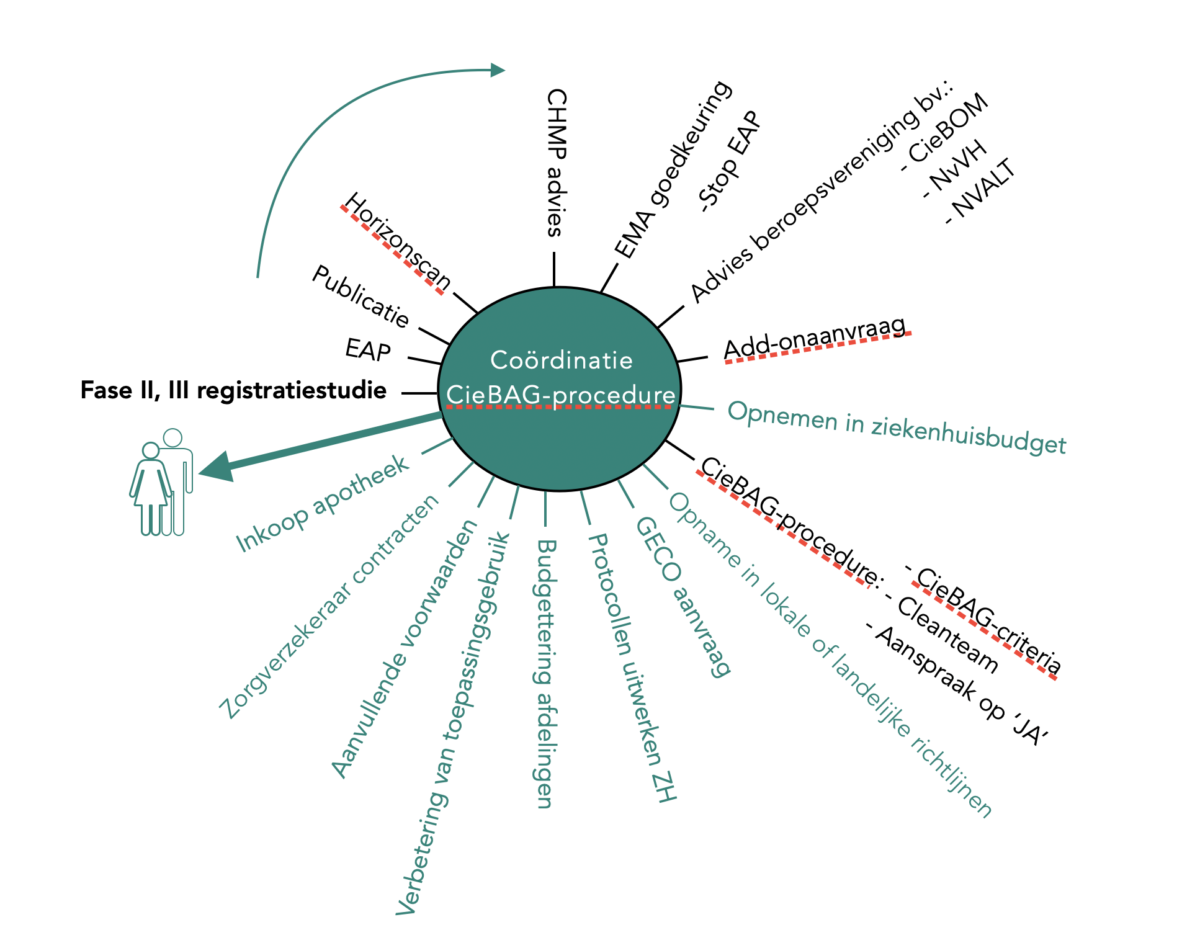
Wheel of access en CieBAG
De Commissie Beoordeling Add-onGeneesmiddelen maken bindende afspraken over geneesmiddelen die niet in aanmerking komen voor de sluis, maar wel nieuw zijn op de markt, of er een nieuwe indicatie-uitbreiding is, of wanneer er sprake is van een beperkt behandeladvies.
Binnen de CieBAG-procedure worden ook de geneesmiddelen die de CieDAP- of de NOWG-procedure doorlopen weergegeven. De procedures zijn verschillende maar uiteindelijk bepaalt de zorgverzekeraar de criteria voor toelating, de aanspraak voor het geneesmiddel en de contractafspraak.
Het Wheel of access is een organiserend principe wat handvatten biedt voor de markt-, ziekenhuistoegang van add-ongeneesmiddelen. De fase II en III registratiestudies zijn het vertrekpunt voor markttoelating en eindigt bij het voorschrijven aan patiënten.
- De bovenste helft van het ‘Wheel of access’ zijn formele processtappen die door de overheid worden bepaald. Dit zijn markttoelatingsvoorwaarden. Na EMA-goedkeuring en aanvraag van een add-onvergoeding, kunnen in principe de CieBAG markttoelatingsvoorwaarden en de prijsonderhandelingen van het cleanteam aanvangen. De gemiddelde doorlooptijd binnen deze procedure tot markttoelating is niet bekend.
- De onderste helft van het ‘Wheel of access’ beschrijft de afstemmingsprocessen die ziekenhuizen moeten doorlopen vanaf markttoelating om geneesmiddelen uiteindelijk aan patiënten te kunnen voorschrijven. Ook hier kan de doorlooptijd sterk variëren en ligt tussen de 1 en 6 maanden.